Teoría de enlace por valencia (TEV)
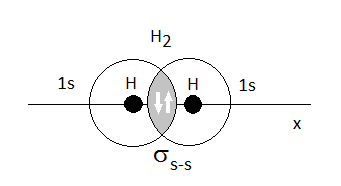
Esta es la primera teoría "cuántica" del enlace covalente. Se basa en la idea de que para que se forme un enlace covalente, los átomos deben acercarse de modo que los orbitales de la capa de valencia solapen en el espacio, así, los electrones dejarían de estar descritos exclusivamente por la función de onda correspondiente a uno de los átomos para pasar a serlo por una combinación de ambas:

f1 f2 Y=C1·f1 + C2·f2
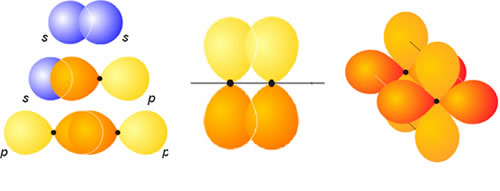
Si el enlace resultante tiene simetría cilíndrica, como es el caso del H2, se dice que el enlace es s (sigma). Si por el contrario, tiene un plano de simetría, lo llamaremos p (pi).



Teoría de orbitales moleculares (TOM)
La TOM se basa en intenta resolver la ecuación de Schrödinger para moléculas, lo cuál supone un reto, al incorporar a la ecuación nuevos centros de carga, distancias e interacciones. El problema es tan complejo que desde el principio es necesario emplear aproximaciones para su resolución. La más simple es la de tomar como primera aproximación a los orbitales moleculares (OM) una combinación lineal de orbitales atómicos (CLOA), y luego ir modificando estos en un proceso iterativo hasta un determinado grado de aproximación prefijado.
Aplicando ese formulismo a las moléculas diatómicas, se obtienen, como en el caso atómico, los orbitales moleculares y sus energías relativas:


La distribución de electrones en los OM sigue las mismas reglas que en los átomos (aufbau, Pauli y Hund).
En este modelo, en lugar de hablar de enlaces simples dobles, etc., se usa el concepto de orden de enlace, que es la mitad del número de electrones enlazantes menos el de no enlazantes. Coincide con lo anterior, pero además puede ser semientero en especies ionizadas.
Una singularidad de la TOM es que predice el paramagnetismo del oxígeno molecular, cosa que no hace ninguna otra teoría hasta este momento, gracias a par de orbitales pi.




No hay comentarios:
Publicar un comentario