La constante de velocidad sólo depende de la temperatura, y la ecuación que describe esa dependencia se debe a Svante Arrhenius:
kv=A·e-Ea/RT
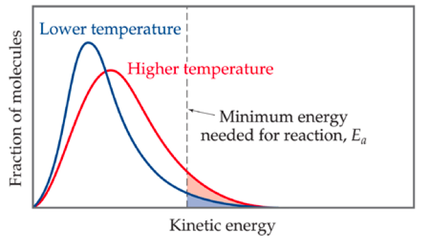
donde A es el factor preexponencial, Ea es la energía de activación (energía mínima para que una reacción tenga lugar) y T la temperatura. Como puede verse, la ecuación predice que un incremento de la temperatura implica un incremento de la constante de velocidad, y por ello de la velocidad. Eso se explica porque habrá más moléculas con energía superior a la energía de activación y por lo tanto aumentará la frecuencia de colisiones efectivas:
Una representación gráfica del logaritmo neperiano de la constante de velocidad frente al inverso de la temperatura debe ser lineal y la pendiente permite el cálculo de la energía de activación:
L(kv)=L(A) - Ea/RT
El factor preexponencial A de Arrhenius da cuenta de la probabilidad de choques con la geometría adecuada entre los reactivos, mientras que el factor energético de las colisiones se tiene en cuenta en la energía de activación. La teoría de colisiones no puede predecir valores de la energía de activación, de modo que ésta se introduce como un parámetro ajustable en el modelo.
En la actualidad, y dado que la teoría de colisiones da resultados poco coincidentes con los experimentales, se ha desarrollado una nueva teoría para modelar las reacciones químicas, denominada teoría del complejo activado. Esta teoría postula la formación de una estado de transición intermedio entre reactivos y productos en el que los enlaces ni se han roto ni se han formado. Este estado de transición es el complejo activado, la diferencia entre su energía y la de los reactivos sería la energía de activación. El complejo activado es modelable teóricamente mediante programas de ordenador que calculan sus funciones de onda y valores de energía, lo que permite cotejar valores con la práctica, y así, mediante un proceso de ensayo y error, ir ajustando el complejo activado al máximo.





No hay comentarios:
Publicar un comentario