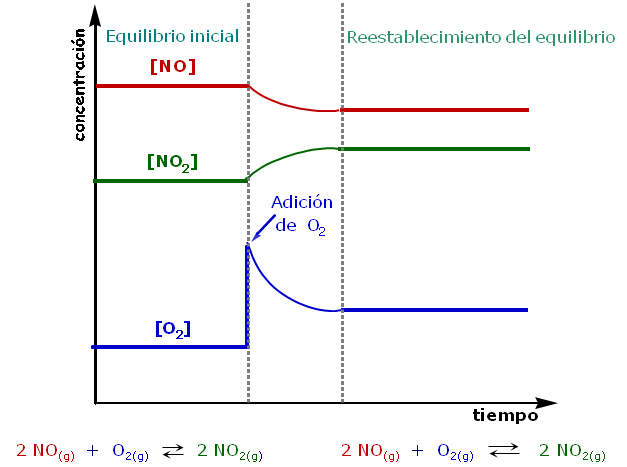
Los cambios en un equilibrio químico inducidos por la concentración pueden ser predichos por el principio de Le Chatelier, debido a que la constante de equilibrio no se ve afectada nada más que por la temperatura. Sea el equilibrio 2 NO + O2 = 2 NO2, si se agrega oxígeno, según Le Chatelier, el equilibrio se desplazará hacia los productos para consumirlo, y eso ocurre porque el NO tendrá que reaccionar con el oxígeno extra añadido para formar más producto, haciendo disminuir los reactivos, de modo que, al final, se mantenga constante el valor de la constante:
La posición de equilibrio en cualquier reacción representa siempre la situación de mínimo valor de la energía de Gibbs y de máxima entropía.
Existe una relación entre la constante de equilibrio y la energía de Gibbs:

Cabe indicar que esa constante no es ni Kp ni Kc, sino la constante termodinámica, en la que las sustancias disueltas se expresan en concentración molar y los gases en atmósferas. Cuando se trata de equilibrios homogéneos entre gases, K=Kp, y cuando se trata de equilibrios homogéneos en disolución, K=Kc.
En los equilibrios homogéneos, un concepto muy frecuente es el de grado de disociación: se define como el cociente entre la cantidad de sustancia disociada y la cantidad inicial, pudiéndose a veces indicar como tanto por ciento:
Hasta ahora, todos los equilibrios tratados consistían de una única fase homogénea, bien fuera gaseosa o bien en disolución. Se llaman equilibrios heterogéneos aquellos que presentan más de una fase, por ejemplo: un sólido y gases, o una disolución y un sólido. La única diferencia con los equilibrios homogéneos es que los sólidos y líquidos puros no aparecerán en la constante de equilibrio, tan sólo los gases o las sustancias en disolución. Por ejemplo, para la reacción: CaCO3(s) = CaO(s) + CO2(g), Kp=P(CO2). Un poco más adelante trataremos un tipo especial de equilibrios heterogéneos: los de precipitación o solubilidad.
Se llama solubilidad a la cantidad máxima de un soluto que se pueden disolver en 100 g de un disolvente. Representa la concentración de la disolución saturada a una determinada temperatura.
Los equilibrios de precipitación son aquellos en los que se representa el proceso de disolución de una sustancia, generalmente poco soluble, por lo que en el equilibrio tenemos un sólido en equilibrio con sus iones en disolución. Por ejemplo:
AgCl(s) D Ag+(aq) + Cl-(aq)
PbI2(s) D Pb2+(aq) + 2 I-(aq)
Las constantes de estos equilibrios se denominan producto de solubilidad (Ks, Kps ó Ps), y siguen las reglas vistas con anterioridad:
Ps(AgCl)=[Ag+(aq)]·[Cl-(aq)]
Ps(PbI2)=[Pb2+(aq)]·[I-(aq)]2
Si llamamos s a la solubilidad, se puede relacionar con el producto de solubilidad. Por ejemplo, si hay disueltos s mol/L de yoduro de plomo(II), habrá en el equilibrio s mol/L de iones plomo(II) y 2s mol/L de iones yoduro, y de ahí:
Efecto del ión común.
Llamamos así al descenso de la solubilidad de una sustancia cuando junto a ella, se disuelve otra, usualmente muy soluble, que comparte con ella un ión. Se puede considerar una consecuencia del principio de Le Chatelier, aplicado al caso concreto de los equilibrios de precipitación: al haber una fuente "externa" de iones (productos) el equilibrio de precipitación se desplaza hacia los reactivos, y disminuye así la solubilidad.
Llamamos así al descenso de la solubilidad de una sustancia cuando junto a ella, se disuelve otra, usualmente muy soluble, que comparte con ella un ión. Se puede considerar una consecuencia del principio de Le Chatelier, aplicado al caso concreto de los equilibrios de precipitación: al haber una fuente "externa" de iones (productos) el equilibrio de precipitación se desplaza hacia los reactivos, y disminuye así la solubilidad.
Formación de precipitados.
Que una sustancia precipite o no dependerá de que se supere o no su producto de solubilidad, de modo que basta con sustituir en la fórmula del mismo las concentraciones iniciales y comparar el resultado con el dado. Si lo supera, entonces precipitará.
Que una sustancia precipite o no dependerá de que se supere o no su producto de solubilidad, de modo que basta con sustituir en la fórmula del mismo las concentraciones iniciales y comparar el resultado con el dado. Si lo supera, entonces precipitará.
Redisolución de precipitados.
Un precipitado puede redisolverse actuando sobre el equilibrio de precipitación, de modo que se desplace hacia los productos (los iones). Esto se puede conseguir de muy diversas formas, por ejemplo, los haluros de plata se pueden redisover añadiendo amoniaco, que formará con los iones plata un ión complejo que consigue desplazar el equilibrio en el sentido de la disolución del sólido; o los hidróxidos metálicos, que se pueden redisolver bajando el pH añadiendo algún ácido, o el yoduro de plomo(II), que se puede redisolver calentando la disolución.
Un precipitado puede redisolverse actuando sobre el equilibrio de precipitación, de modo que se desplace hacia los productos (los iones). Esto se puede conseguir de muy diversas formas, por ejemplo, los haluros de plata se pueden redisover añadiendo amoniaco, que formará con los iones plata un ión complejo que consigue desplazar el equilibrio en el sentido de la disolución del sólido; o los hidróxidos metálicos, que se pueden redisolver bajando el pH añadiendo algún ácido, o el yoduro de plomo(II), que se puede redisolver calentando la disolución.




No hay comentarios:
Publicar un comentario