Los elementos del bloque d son todos metales, y se suelen denominar metales de transición, aunque el último, el Zn, se suele sacar de esta clasificación por no compartir muchas de las propiedades de los demás.
Estas propiedades son las siguientes:
- altas densidades y puntos de fusión y ebullición
- gran diversidad de estados de oxidación

El electrón diferenciador de estos elementos llena el orbital 3d, según las reglas conocidas, con dos excepciones: Cr y Cu, que se deben memorizar:
El Zn no aparece porque tiene un solo estado de oxidación (+2), y la capa 3d estaría llena, y vamos a definir los elementos de transición como aquellos que forman iones que tienen incompleta la capa 3d.
- capacidad de formar iones complejos
- capacidad de formar iones coloreados tanto simples como complejos
- empleo como catalizadores, como el Fe en el proceso Haber, el V en el de contacto o NI y Pt para la hidrogenación de alquenos
- propiedades magnéticas en forma elemental y combinado, dado que tienen electrones desapareados, los elementos y sus compuestos suelen ser paramagnéticos, dándose casos de ferromagnetismo también (Fe y Co). El momento magnético depende del número de electrones desapareados, hecho que se puede emplear para dilucidar estructuras.
- forman aleaciones, debido a que tienen tamaños similares y pueden intercambiarse entre sí dentro de la red metálica; algunas de estas aleaciones tienen propiedades notables: acero inoxidable, acero al cromo, latón, bronce, etc.
Complejos de los metales de transición
Estos compuestos contienen un ión de un metal de transición unido mediante enlaces covalentes dativos o coordinados a otras moléculas o iones llamados ligandos. También se pueden denominar compuestos de coordinación.
Los ligandos pueden ser monodentados, si solo pueden formar un enlace dativo, o polidentados o quelatos, si pueden formar varios.
- Ligandos monodentados: haluros, el agua o el amoniaco
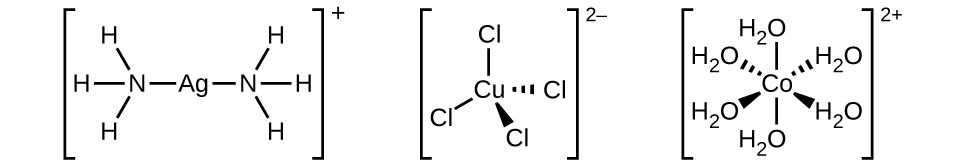
- Ligandos polidentados o quelatos: etilendiamina, oxalato, o AEDT
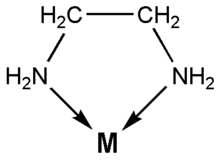
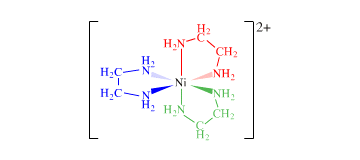

Muchos complejos con quelatos presentan isomería óptica:

El AEDT se emplea en la eliminación de metales pesados, en terapias de quelación, en tratamiento de aguas duras y como conservante alimentario.
Los complejos de coordinación presentan números de coordinación de 6 (octaédricos) o 4 (tetraédricos o plano cuadrados). Estas estructuras no se pueden deducir mediante la VSEPR, deben obtenerse del estudio de las estructuras por rayos X.

No hay comentarios:
Publicar un comentario