Las propiedades de los compuestos covalentes moleculares está determinada por la fortaleza de las interacciones que se desarrollan entre sus moléculas. Las interacciones intermoleculares se pueden clasificar del siguiente modo:
- Puentes de hidrógeno
- Fuerzas de Van der Waals
- Dipolo-dipolo
- Dipolo-dipolo inducido
- Dipolo instantáneo-dipolo instantáneo o de London
Los puentes de hidrógeno aparecen cuando tenemos H unido a F, O ó N (los tres elementos más electronegativos). Lo que ocurre entonces es que, dado que el H es muy pequeño y tienen un solo electrón, y el otro átomo es muy electronegativo, y atrae fuertemente al par de enlace, se genera un dipolo muy intenso en la molécula que, consecuentemente genera una potente interacción entre las moléculas. Esta interacción es la responsable de las excepcionales propiedades del agua, el amoniaco y el fluoruro de hidrógeno; de la complementariedad entre las bases nitrogenadas de las hebras de ADN; de parte de la estructura secundaria de las proteínas; de parte de la reactividad de las enzimas, etc.
Quizás esta es la gráfica más usada para verificar el efecto de los puentes de hidrógeno en propiedades de las sustancias, concretamente el punto de ebullición. Es evidente que en fluoruro de hidrógeno, agua y amoniaco, el punto de ebullición es anómalo, debido a la presencia de los puentes de hidrógeno. Además, se puede entender el orden: el agua puede formar dos pares de puentes de hidrógeno, al tener dos hidrógenos y dos pares de no enlace, sin embargo, las otras dos sustancias solo pueden forma un par, al tener o solo un H o solo un par de no enlace. Y dentro de estos dos últimos, dado que el dipolo es más fuerte en fluoruro de hidrógeno que en amoniaco, por la mayor diferencia de electronegatividad, también es más alto el punto de ebullición.
Otro efecto importante es sobre la solubilidad, pues las sustancias que pueden formar puentes de hidrógeno con el agua (alcoholes, por ejemplo) son solubles en ella, siempre y cuando su tamaño no sea muy grande.
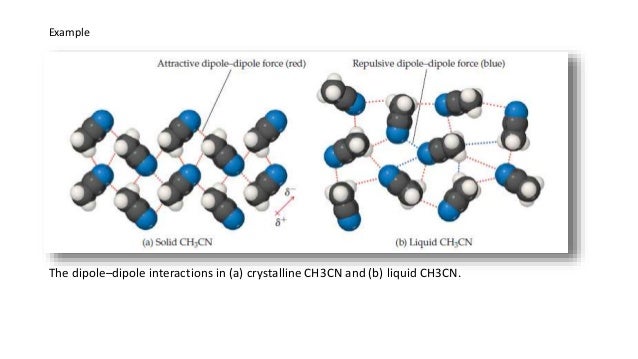
Las interacciones dipolo-dipolo se da entre moléculas polares como el HCl o PCl3, por ejemplo. Son similares a los puentes de hidrógeno, pero menos intensas.
Las interacciones dipolo-dipolo inducido se dan en mezclas de sustancias y por ello no las consideraremos aquí.
Finalmente, las interacciones dipolo instantáneo-dipolo instantáneo o de London son universales y se producen como consecuencia del movimiento caótico de los electrones de las moléculas, que, en un instante dado, producen una separación de carga que resulta en un pequeño dipolo que interacciona con los demás que se generan en otras moléculas. A pesar de ser las más débiles de las interacciones, son importantes en bioquímica, debido a que las fuerzas de London aumentan con el tamaño y las biomoléculas son muy grandes. También son responsables del aumento del punto de fusión de sustancias apolares como los hidrocarburos, los halógenos o los gases nobles.




No hay comentarios:
Publicar un comentario