Las estructuras de Lewis son representaciones planas de los enlaces en la molécula, realizadas con la premisa de que debe completarse el octete electrónico para todos los átomos presentes.
En la práctica, el octete electrónico sólo se cumple estrictamente en elementos del primer periodo, concretamente C, N, O y F; en el caso del B o el H, el octete electrónico no puede alcanzarse por déficit de electrones; y en el resto de los elementos, es posible superarlo ampliamente (esto se llamó expansión del octete, pero esa es una idea obsoleta hoy en día).
A la hora de hacer estructuras Lewis de moléculas, se debe escoger como más adecuada aquella que tenga menos carga formal, aunque ello implique incumplir la regla del octete. La carga formal se determina repartiendo equitativamente los electrones compartidos entre los átomos y comparando con la configuración de valencia original.
Cuando tratamos con especies con enlaces múltiples, es posible que existan varias opciones respecto a dónde colocar tales enlaces. Ese fenómeno se llama resonancia y cada una de las representaciones que tratan de describir a la especie química, forma de resonancia. No debe interpretarse que la molécula es a veces una cosa y a veces otra, o que algunas moléculas son de un tipo y otras de otra, la resonancia trata de representar que los enlaces no son ni simples ni múltiples sino intermedios, pero siendo todos los implicados idénticos entre sí e indistinguibles (ver otras explicaciones en estas WEB1, WEB2, WEB3).
El ejemplo más conocido de resonancia es el del benceno, C6H6, que en química orgánica se denomina aromaticidad:
En ocasiones, los dos electrones compartidos los aporta un único átomo, como en el ión amonio, en ese caso, el enlace covalente se denomina dativo o coordinado, pero hay que resaltar que es un enlace covalente idéntico e indistinguible de los demás.
En esta WEB podéis ver más ejemplos y ejercicios al respecto de las estructuras Lewis y la resonancia.
Las estructuras de Lewis son planas y no representan la geometría de las especies químicas, y ese es uno de los objetivos del estudio de las moléculas. Para predecir la geometría, usamos la Teoría de la Repulsión de los Pares de Electrones de la Capa de Valencia, (Valence Shell Electron Pair Repulsion, VSEPR). Según esta teoría, los pares de electrones que puedan existir alrededor de un átomo, se ubican los más alejados posible entre sí para minimizar las repulsiones entre ellos.
Los pares de electrones se dividen en dos grupos, aquellos que forman enlaces y que unen átomos, y los que no; los primeros se denominan pares de enlace (X) y los segundos, pares de no enlace (E). A efectos de la VSEPR, los enlaces múltiples cuentan como un solo par.
Una vez que hemos dividido los electrones en pares, la geometría básica está determinada, y luego la intensidad relativa de las repulsiones entre los distintos pares, la modificará ligeramente. Para ello se debe tener en cuenta que los pares de no enlace se repelen con más intensidad entre sí que con los de enlace, y éstos entre sí son los que menos se repelen: E-E>E-X>X-X (Ver tutorial en esta WEB).
Prueba este SIMULADOR que aplica el modelo VSEPR a varias especies que luego a aparecen en la hoja de problemas. Esta otra PÁGINA incluye un pequeño tutorial y varios ejercicios autoevaluables. Finalmente, en esta último ENLACE puedes encontrar un tutorial.
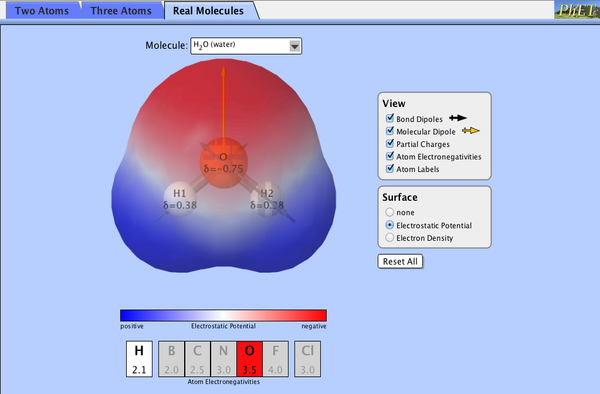
Una vez que conocemos la geometría de la molécula, cabe preguntarse por su polaridad. Para que una molécula sea polar, es necesario que tenga enlaces polares y además, que los momentos dipolares individuales no se anulen entre sí.
Este applet permite visualizar los dipolos de los enlaces y el dipolo molecular neto resultante en varias moléculas y modelos:
Ejercicios de aplicación:
Todo lo que hemos visto hasta ahora en cuanto a enlace covalente, corresponde a sustancias que forman moléculas. Sin embargo, existen otras sustancias, cuyos átomos también se unen entre sí por enlaces covalentes, formando estructuras tridimensionales extendidas (redes covalentes gigantes) sin que existan moléculas. Estas sustancias, llamadas a veces compuestos covalentes gigantes o reticulares, tienen propiedades radicalmente diferentes a los compuestos covalentes moleculares, pues las de éstos viene determinada por la intensidad de las fuerzas intermoleculares que veremos más adelante. Algunas de estas sustancias covalentes reticulares son el diamante o el grafito o el grafeno (todos son formas alotrópicas del carbono), el silicio (Si), el cuarzo (SiO2)
En el diamante, el carbono está unido covalentemente a otros cuatro átomos de carbono mediante enlaces simples, resultando en una estructura tetraédrica con ángulos de 109.5º. En el grafito, los átomos se unen sólo a otros tres, en una estructura trigonal plana con ángulos de 120º, formando láminas que luego se unen entre sí mediante fuerzas de London. Existen además enlaces dobles deslocalizados en las láminas de un modo similar a lo que sucede en el benceno. El grafeno es básicamente igual que el grafito, ya que es una única de las láminas que forma del grafito. Finalmente, los fullerenos y nanotubos tienen una estructura en la que los átomos de carbono se unen a otros tres átomos en estructuras que pueden ser hexagonales o pentagonales, pero en cualquier caso, no planas; al igual que el grafito, ambos presentan electrones deslocalizados, y los ángulos de enlace son intermedios entre 109 y 120º. La diferencia entre ambos es que los nanotubos son redes covalentes, mientras que los fullerenos son moleculares, y por lo tanto, presentan entre ellos fuerzas de London, como las láminas de grafito.
Estructura del dióxido de silicio (cuarzo), en negro el silicio, en rojo el oxígeno
La estructura del silicio es idéntica a la del diamante, y la del dióxido de silicio (cuarzo o cristal de roca), que se ve arriba puede verse como si intercalasemos un átomo de oxígeno entre cada dos átomos de silicio unidos, de modo que un átomo de silicio y cuatro de oxígeno forman tetraedros, que se unen entre sí por los vértices, dando así lugar a la estructura del cuarzo. En cualquier caso, ambos son compuestos covalentes reticulares.
Imagen Jmol del grafito
Imagen Jmol del diamante
Imagen Jmol del fullereno (Este es un compuesto molecular, pero conviene verlo aquí, junto a los otros alótropos del carbono)
Los compuestos covalentes reticulares son muy duros (el diamante es la sustancia más dura de la Tierra), pero no son frágiles como los iónicos; tienen puntos de fusión muy altos, son aislantes térmicos y eléctricos (hay excepciones a esto, como el grafito, por ejemplo) y no suelen ser solubles en ningún tipo de disolvente.





No hay comentarios:
Publicar un comentario