La cinética es la rama de la química que estudia la velocidad a que suceden las reacciones químicas y la manera en que lo hacen. Su estudio permite:
- determinar la rapidez con que ocurre una reacción
- determinar las mejores condiciones para que suceda
- proponer un mecanismo de reacción
La cinética es una parte de la química eminentemente experimental, en la que hay pocas certezas y generalidades que se puedan trasladar entre diferentes reacciones o sistemas.
Sea una reacción genérica:
a A + b B -----> p P + q Q
Se define velocidad de reacción, v, como el ritmo de desaparición de los reactivos o de aparición de los productos:
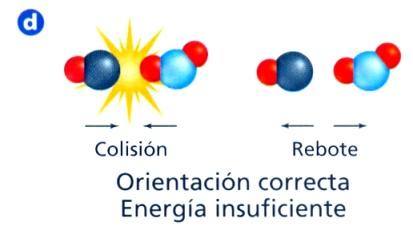
La teoría de las colisiones establece que para que ocurra una reacción, los reactivos deben colisionar entre sí con una energía suficiente (energía de activación) y una orientación adecuada. La velocidad de reacción entonces dependerá de la frecuencia de las colisiones eficaces (número de colisiones eficaces por unidad de tiempo)
La energía de activación es la cantidad mínima de energía cinética que deben tener las partículas en colisión para que ésta sea efectiva. Una mayor temperatura aumenta la fracción de partículas que superan esa energía y consiguientemente el número de colisiones por unidad de tiempo y por ende, la velocidad de la reacción. Pincha en la imagen para ir a un simulador de la distribución de Maxwell-Boltzmann:
El perfil genérico de una reacción química puede ser uno de los siguientes, dependiendo de si es exotérmica o endotérmica:
Las reacciones más rápidas son aquellas que tienen energías de activación más bajas, y viceversa.
La velocidad de reacción depende de los siguientes factores:
- Concentración/presión: cuanto mayor sea, mayor será la velocidad, debido a que hay más oportunidades para que se de la reacción.
- Temperatura: experimentalmente se constata que todas las reacciones van más rápido a mayor temperatura; frecuentemente, un aumento de 10 ºC supone la duplicación de la velocidad de reacción, pero esta regla falla en muchas ocasiones.
- Grado de división: cuanto mayor sea la superficie de contacto entre los reactivos, mayor será la velocidad de reacción; esto es muy importante cuando hay implicados sólidos y/o líquidos.
- Luz: algunas reacciones químicas aumentan mucho su velocidad cuando se exponen a la luz solar. Eso sucede porque la luz ultravioleta es capaz de romper algunos enlaces de algún reactivo. Un ejemplo de ello son los haluros de plata (fundamento de la fotografía clásica), el nitrato de plata, el peróxido de hidrógeno y el ácido nítrico, que son fotosensibles y se descomponen parcialmente con la luz solar.
Los catalizadores son sustancias que, añadidas a una reacción, aumentan, sin consumirse, su velocidad proporcionando un nuevo mecanismo de reacción que tiene una menor energía de activación (ver 16.2).
Pensando en términos de la distribución de Maxwell-Boltzman, al disminuir la energía de activación del proceso, lo que ocurre es que la fracción de moléculas con energías suficientes para producir una colisión efectiva aumenta, y por lo tanto, la frecuencia de colisiones efectivas también aumenta y por ende, la velocidad de la reacción:
La catálisis puede ser homogénea o heterogénea, dependiendo de si el catalizador está o no en la misma fase que los reactivos obre los que actúa. Un ejemplo de catálisis homogénea lo constituyen las enzimas, que son proteínas que, mediante un mecanismo de llave-cerrojo hacen que los reactivos se encuentren adecuadamente para que reaccionen. Y un ejemplo de catalizador heterogéneo es el que incorporan todos los coches con motores de combustión para eliminar los gases nocivos delos escapes, y que consiste en una matriz cerámica porosa sobre la que se ha depositado una combinación de partículas metálicas de tamaño muy pequeño.
Para determinar la velocidad de una reacción, se debe medir la cantidad/concentración/presión de una de las sustancias implicadas a lo largo del tiempo. Con esos datos se traza una gráfica y se determina la pendiente de la curva en cada punto. Dicha pendiente (modificada de acuerdo con la expresión inicial) es la velocidad de reacción:
En este caso se ha graficado un volumen (probablemente de un gas) frente al tiempo, pero para cada reacción, hay que buscar la manera más adecuada para seguirla y calcular la velocidad de reacción:
La catálisis puede ser homogénea o heterogénea, dependiendo de si el catalizador está o no en la misma fase que los reactivos obre los que actúa. Un ejemplo de catálisis homogénea lo constituyen las enzimas, que son proteínas que, mediante un mecanismo de llave-cerrojo hacen que los reactivos se encuentren adecuadamente para que reaccionen. Y un ejemplo de catalizador heterogéneo es el que incorporan todos los coches con motores de combustión para eliminar los gases nocivos delos escapes, y que consiste en una matriz cerámica porosa sobre la que se ha depositado una combinación de partículas metálicas de tamaño muy pequeño.
Para determinar la velocidad de una reacción, se debe medir la cantidad/concentración/presión de una de las sustancias implicadas a lo largo del tiempo. Con esos datos se traza una gráfica y se determina la pendiente de la curva en cada punto. Dicha pendiente (modificada de acuerdo con la expresión inicial) es la velocidad de reacción:
En este caso se ha graficado un volumen (probablemente de un gas) frente al tiempo, pero para cada reacción, hay que buscar la manera más adecuada para seguirla y calcular la velocidad de reacción:
- si se produce una sustancia coloreada, puede seguirse por espectrofotometría
- si se produce una gas, se puede medir el volumen de gas desprendido o la variación de masa debida al desprendimiento del mismo
- si cambia la cantidad de iones del medio, se puede medir la conductividad eléctrica de la disolución
- si cambia la acidez, se puede seguir mediante un pHmetro
- en otras ocasiones, hay que extraer muestras alícuotas de la mezcla de reacción para efectuar una determinación de una de las sustancias
Sea como sea, las medidas llevan a un gráfico similar al de arriba, que luego hay que seguir procesando para obtener información sobre los parámetros cinéticos de la reacción.





No hay comentarios:
Publicar un comentario