Khan Academy
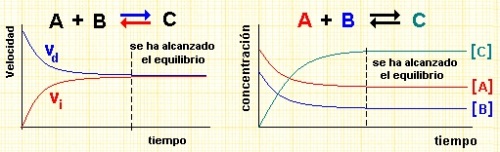
Sea un proceso elemental genérico A + B = C + D, y supongamos que inicialmente sólo tenemos reactivos. Conforme vaya produciéndose la reacción, la concentración de reactivos bajará e irá aumentando la de los productos, de modo que comenzará a ser posible que ocurra la reacción inversa C + D = A + B. Conforme pase el tiempo, la velocidad de la reacción directa disminuirá al ir disminuyendo la concentración de los reactivos, y la de la inversa aumentará, al hacerlo la concentración de productos. En un determinado momento, ambas reacciones tendrán la misma velocidad, y los productos se formarán a la misma velocidad que se recombinan en los reactivos originales, resultando que las concentraciones permanecen constante. Es ese momento diremos que la reacción está en equilibrio químico (DG=0), y como queda demostrado por el modo en que se ha descrito, es una situación dinámica, pues las reacciones no se han detenido, sino que han "congelado" una determinada situación.
Estas reacciones se indican usando la doble flecha, como en la figura. Para ver cómo se establece el equilibrio a nivel molecular haz clic en estos ENLACE1.
Como hemos visto arriba, en el equilibrio, las velocidades directa e inversa se igualan, por lo tanto:
vd=kd·[A]·[B]
vi=ki·[C]·[D]
cuando lleguemos al equilibrio, vd=vi, y entonces kd·[A]·[B]=ki·[C]·[D], agrupando constantes:
donde Kc es la constante de equilibrio. Recordemos que las constantes de velocidad solo dependen de la temperatura; por consiguiente, la constante de equilibrio, que es un cociente de dos constantes de velocidad, también depende solamente de la temperatura.
Para una reacción genérica:
a A + b B = c C + d D,
Esta expresión se conoce como ley de acción de masas de Guldberg y Waage.
La constante de equilibrio también puede expresarse en términos de presión parcial de los gases implicados (cuando la reacción sólo implique a gases). En ese caso, la expresión quedaría:
Kp y Kc están relacionadas, dado que pV=nRT, y entonces, p=(n/V)RT, y n/V es la concentración molar o molaridad del gas considerado:
Todos los equilibrios considerados hasta ahora eran homogéneos, es decir, constaban de una sola fase. Cuando hay más de una fase (sólido y gas, líquido y gas, etc.) el equilibrio se denomina heterogéneo, y la únic diferencia a nivel de constante de equilibrio es que en ella sólo van a aparecer los gases y las sustancias en disolución, y no los líquidos o sólidos que constituyen una fase pura y sin mezclar en sí mismos. Por ejemplo: para la reacción: CaCO3(s) = CaO(s) + CO2(g), Kp=P(CO2)
Independientemente de la expresión que usemos, si el valor de la constante de equilibrio es mucho mayor que 1, significa que hay mucho más producto que reactivo y se dice que el equilibrio está desplazado hacia los productos. Si por el contrario, es mucho menor que 1, ocurre al revés y el equilibrio está desplazado hacia los reactivos.
Dado un conjunto de concentraciones de sustancias iniciales, podemos saber cómo va a evolucionar el sistema calculando el denominado cociente de reacción Q, que es la misma expresión que la constante de equilibrio, pero con las concentraciones en cualquier instante de la reacción, no necesariamente cuando se ha alcanzado el equilibrio.
- Si Q=Kc, el sistema está en equilibrio
- Si Q>Kc, sobran productos y faltan reactivos, y el sistema evolucionará hacia la izquierda
- Si Q<Kc, ocurrirá al revés y evolucionará hacia la derecha
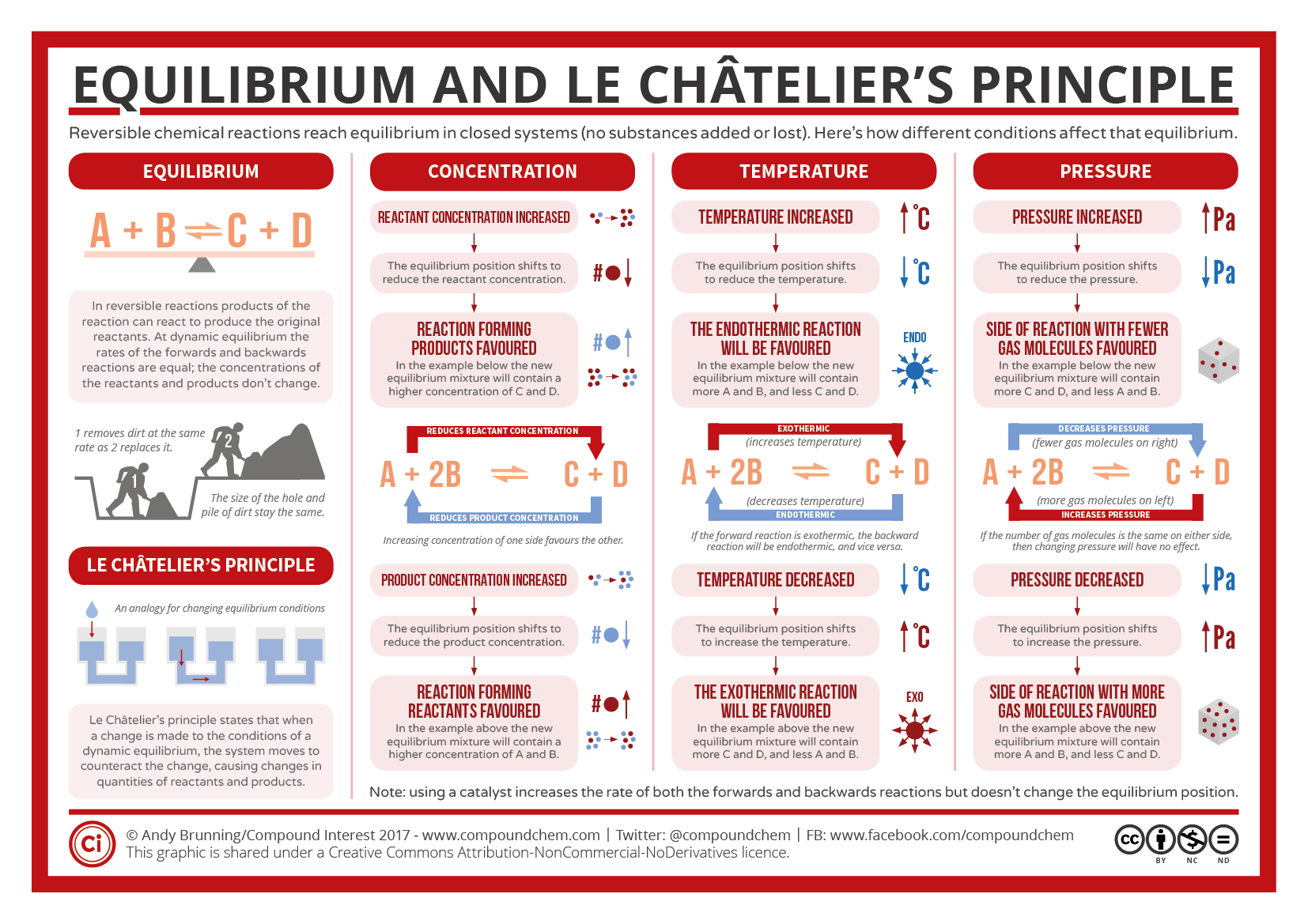
La ley de Le Chatelier dice que el equilibro químico se opone a cualquier cambio que se haga sobre la posición de equilibrio. Eso se consigue desplazando el equilibrio hacia uno de los lados.
- Cambiando la temperatura. Este es el único caso en que la constante de equilibrio cambia. Si el equilibrio es exotérmico y aumentamos la temperatura, tratará de compensarlo, absorbiendo energía desplazándose en sentido endotérmico, o sea en este caso, hacia los reactivos. Por o tanto, la constante disminuye. Si el equilibrio es endotérmico ocurriría al revés.
- Cambiando las cantidades de alguna de las sustancias involucradas. Eso se puede lograr añadiendo más disolución o su presión parcial. Si por ejemplo se aumenta, el equilibrio se desplazará hacia el lado contrario al que está, y al revés si se disminuye.
- Actuando sobre la presión total. Eso se puede conseguir, por ejemplo, cambiando el volumen, y es un cambio que afecta solo a los gases. Si se aumenta la presión, el equilibrio se desplaza hacia el lado en que haya menos moles de gas. En los equilibrios donde no varían los moles de gas, no se altera la posición de equilibrio.





No hay comentarios:
Publicar un comentario