La química orgánica es la química de los compuestos del carbono, y abarca una infinidad de compuestos, incluidos los biológicos. Las características del átomo de carbono que hacen esto posible son:
- puede formar cadenas muy largas uniendo unos átomos de carbono a otros e incorporando otros átomos a estas cadenas
- los átomos de carbono pueden desarrollar enlaces covalentes simples, dobles o triples
- los átomos de carbono pueden formar estructuras cíclicas
Serie homóloga
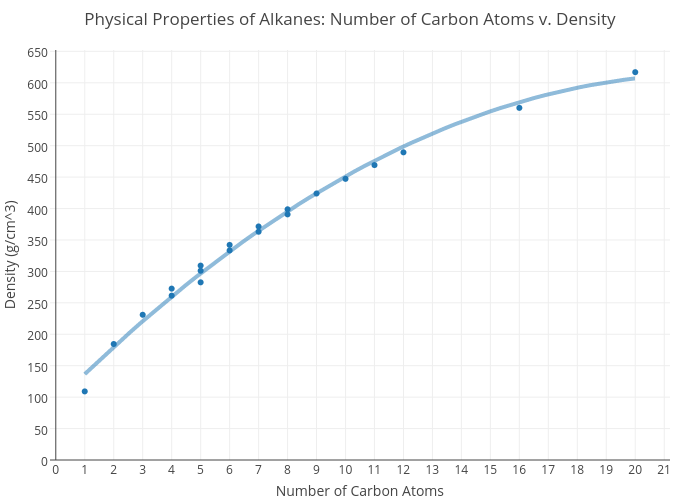
Una serie homóloga es una serie de compuestos que tienen la misma fórmula general, pero difieren en un grupo metileno, -CH2-. Los compuestos de una serie homóloga tienen propiedades químicas similares, pues tienen los mismos grupos funcionales, pero las propiedades físicas van cambiando gradualmente.
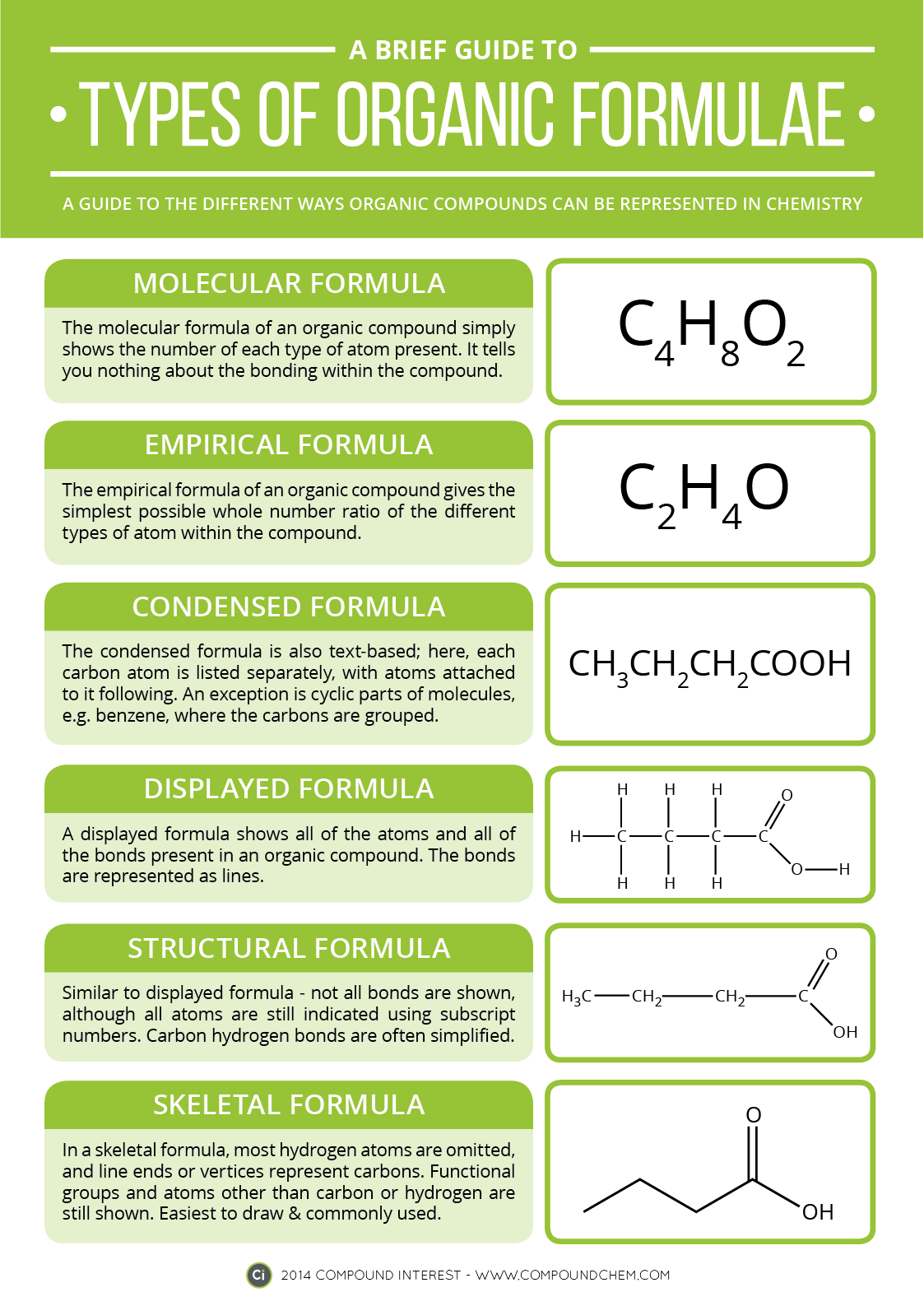
Fórmulas de los compuestos orgánicos
Isomería
Se dice que dos compuestos son isómeros cuando tienen la misma fórmula molecular pero distinta fórmula estructural.

- Isómeros de cadena: sustancias que difieren en la forma de la cadena.
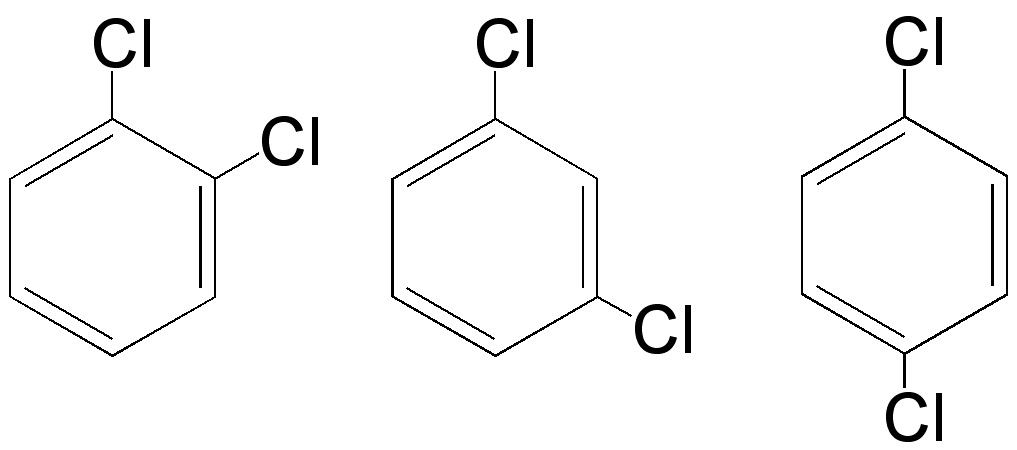
- Isómeros de posición: sustancias que difieren en la posición que ocupa una parte de la molécula.
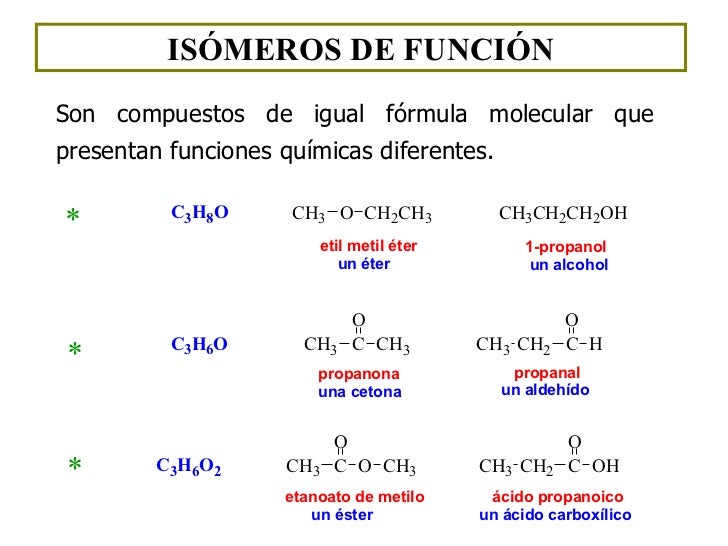
- Isómeros de función: sustancias que presentan la misma función en dos posiciones diferentes, de modo que reciben un nombre distinto. Se da entre alcoholes-éteres, aldehídos-cetonas y ácidos-ésteres.
- Isómeros geométricos: sustancias con un enlace doble que difieren en la posición que ocupan entre sí los fragmentos unidos a los átomos de carbono enlazados por el doble enlace. Para que se de, además del doble enlace, los fragmentos unidos al mismo carbono no pueden ser iguales.
- Isómeros ópticos: sustancias que difieren en la dirección en la que desvían el plano de la luz polarizada. Para que exista, un átomo de carbono debe estar unido a cuatro fragmentos diferentes. Los isómeros ópticos son imágenes especulares no superponibles el uno del otro.
Tipos de compuestos orgánicos
Los compuestos orgánicos consisten fundamentalmente de una cadena más o menos compleja y una serie de grupos funcionales incluidos en ella. Las propiedades físicas del compuesto las determinan fundamentalmente la cadena, mientras que las químicas dependen de los grupos funcionales.
Hay muchos grupos funcionales diferentes. Algunos de ellos se muestran a continuación junto a las fórmulas generales de los compuestos y un ejemplo sencillo:

El nombre de los compuestos orgánicos puede desglosarse en tres partes: los radicales que cuelgan de la cadena principal, la cadena principal y la función principal. En los apuntes siguientes se describe la formulación y nomenclatura de los compuestos orgánicos:
Formulación química v2 from Víctor M. Jiménez Suárez
Emplea este SIMULADOR para dibujar compuestos orgánicos y visualizar sus estructuras tridimensionales.
El benceno C6H6 es la base de todos los compuestos aromáticos de la química orgánica, también llamados arenos. La estructura de abajo es una de las denominadas estructuras de Kekulé, sin embargo, por sí sola no representa bien al benceno pues es sabido que:



Como se ha dicho arriba, dependen fundamentalmente de la cadena, y como consecuencia, de las fuerzas intermoleculares que desarrollen entre sí las distintas moléculas.

En general, un compuesto orgánico será soluble en agua si su grupo funcional puede interaccionar con ésta (puente de hidrógeno o es polar) y la cadena no es muy grande (pues el carácter apolar de la cadena puede contrarrestar el efecto anterior). Cualquier molécula orgánica suficientemente grande no será soluble en agua. Por lo tanto, los primeros alcoholes, aldehídos, cetonas y ácidos carboxílicos sí son solubles en agua, pero esta solubilidad disminuye rápidamente con el tamaño.
Emplea este SIMULADOR para dibujar compuestos orgánicos y visualizar sus estructuras tridimensionales.
El benceno
El benceno C6H6 es la base de todos los compuestos aromáticos de la química orgánica, también llamados arenos. La estructura de abajo es una de las denominadas estructuras de Kekulé, sin embargo, por sí sola no representa bien al benceno pues es sabido que:
- todas las longitudes de enlace C-C son iguales y además, intermedias entre las de un enlace simple y uno doble
- los compuestos 1,2-disustituidos no presentan isómeros, cosa que sí sucedería con esta estructura
- la reactividad química no es la típica de los alquenos (adición), sino que dan sustituciones
- la hidrogenación del benceno es menor que la de tres enlaces dobles, lo que indica que el benceno es más estable que la estructura de Kekulé
Todos estos indicios, hicieron que Pauling propusiera que el benceno era el resultado de la resonancia de dos estructuras de Kekulé:
La resonancia proviene del hecho de que los seis orbitales p perpendiculares al plano hexagonal y cm un electrón cada uno, solapan lateralmente entre sí formando una nube de electrones pi deslocalizada por encima y por debajo del plano molecular:
La siguiente imagen es una imagen de microscopía electrónica de barrido de una molécula de benceno depositada sobre una superficie plana de grafito, mostrando la perfecta forma hexagonal sin distorsiones de la molécula:
Propiedades físicas generales de los compuestos orgánicos
Como se ha dicho arriba, dependen fundamentalmente de la cadena, y como consecuencia, de las fuerzas intermoleculares que desarrollen entre sí las distintas moléculas.
Puntos de fusión y ebullición y volatilidad
El punto de ebullición y por ende la volatilidad de una sustancia orgánica depende de varios factores:- Tipo de fuerza intermolecular presente: recordemos que los puentes de hidrógeno son más fuertes que las interacciones dipolo-dipolo, y éstas que las de London

- El peso molecular: a lo largo de una serie homóloga, es de esperar que aumenten los puntos de fusión y ebullición y disminuya la volatilidad debido al incremento de las fuerzas intermoleculares al aumentar el tamaño de la cadena.
- La simetría (o asimetría) de las moléculas: las moléculas con más ramificaciones interaccionan peor entre sí, y por tanto presentan menores puntos de ebullición:
Solubilidad en agua
En general, un compuesto orgánico será soluble en agua si su grupo funcional puede interaccionar con ésta (puente de hidrógeno o es polar) y la cadena no es muy grande (pues el carácter apolar de la cadena puede contrarrestar el efecto anterior). Cualquier molécula orgánica suficientemente grande no será soluble en agua. Por lo tanto, los primeros alcoholes, aldehídos, cetonas y ácidos carboxílicos sí son solubles en agua, pero esta solubilidad disminuye rápidamente con el tamaño.





No hay comentarios:
Publicar un comentario