Esa transición energética corresponde a los orbitales 3d, que cambian ligeramente de energía, a cusa de la influencia que los ligandos hacen sobre ellos. El resultado es que los 5 orbitales 3d, inicialmente idénticos en energía, se dividen en dos grupos: tres ligeramente más estables y dos ligeramente menos estables.
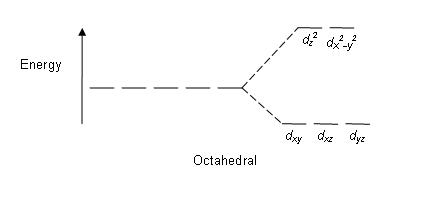

La diferencia de energía entre estos dos grupos de niveles depende de varios factores:
- el metal: distintos metales tienen distintos colores para un mismo ligando, evidentemente eso está relacionado con el número atómico del metal
- la carga del metal: cuanto mayor sea la carga, mayor será la diferencia de energía
- la naturaleza del ligando: la interacción de un ligando con un ión metálico no es siempre igual, sino que hay ligandos que interaccionan más fuertemente que otros, eso se computa en la serie espectroquímica:

- la geometría del complejo: en los tetraédricos es la mitad que en los octaédricos.


No hay comentarios:
Publicar un comentario