Experimentalmente, se ha encontrado que la velocidad de las reacciones químicas puede representarse por una ecuación del siguiente tipo (Ecuación de Guldberg y Waage):
v=kv·[A]α·[B]β
a y ß se denominan órdenes parciales de reacción respecto a A y B, respectivamente, a+ß es el orden total; kv es la constante de velocidad, que sólo depende de la temperatura
Cuando se trata de estudiar la cinética de una reacción, se procura aislar el efecto de cada reactivo, y la manera más simple es poner una gran exceso de todos los demás, de modo que su variación sea despreciable. De ese modo, la ecuación de arriba se queda como
v=k'v·[A]α
Una vez obtenidos los órdenes parciales, se hacen otra serie de experimentos para determinar la constante de velocidad.
Habitualmente, se estudia cómo varía la concentración del reactivo A con el tiempo, y una vez que se obtienen los datos, se hacen las representaciones gráficas de [A] vs t, L[A] vs t, y 1/[A] vs t. Aquella en la que los datos se acomoden mejor indica el orden parcial correspondiente al reactivo A.
Desafortunadamente, no es infrecuente que los datos tengan una incertidumbre tal que haga difícil realizar la elección anterior con garantías. En esos casos, no queda otra que volver al laboratorio y tratar de obtener más y mejores datos.
Virtual Chemistry ExperimentsEs poco frecuente que una reacción química ocurra en una sola etapa y tal y como se escribe. Lo habitual es que ocurran mediante un mecanismo de reacción. Se denomina mecanismo de reacción a la descripción de las etapas por las que se desarrolla un proceso químico global.
Cada una de las etapas que conforman un mecanismo de reacción se denomina proceso elemental, y el número de moléculas que interviene en un proceso elemental se llama molecularidad. Los procesos elementales presentan molecularidad 1 o 2.
La siguiente reacción ocurre en un solo paso:
H2 + I2 ---> 2 HI
La misma reacción, pero con bromo o cloro ocurre mediante un mecanismo complejo:
Cl2 + UVA ---> 2 Cl
Cl + H2 ---> HCl + H
H + Cl2 ---> HCl + Cl
H + H ---> H2
Cl + Cl ---> Cl2
H + Cl ---> HCl
Global: H2 + Cl2 + UVA ---> 2 HCl
La velocidad de una reacción que ocurre mediante un mecanismo es la del paso más lento que se denomina etapa determinante de la reacción. Si se desea acelerar una reacción que sucede por un mecanismo mediante la adición de un catalizador, éste debe actuar sobre el paso determinante, pues si no, será inoperante.
En los mecanismos de reacción, las especies intermedias que se generan, pero que no son productos de la reacción se denominan intermedios de reacción.




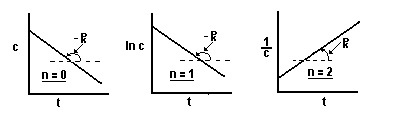
No hay comentarios:
Publicar un comentario