La reactividad de los compuestos orgánicos se puede estudiar asumiendo que los grupos funcionales que presentan las moléculas reaccionan de forma independiente, sin influirse unos a otros. Esa sistematización, se basa en lo siguiente:
- Las cadenas hidrocarbonadas pueden ser alifáticas o aromáticas, pudiendo las primeras ser saturadas o insaturadas.
- Las especies atacantes pueden ser de tres tipos: radicales libres (con un electrón desapareado), electrófilos (con carga positiva y afinidad por los centros con densidad electrónica) o nucleófilos (con carga negativa y afinidad por los centros con déficit de electrones).
- Las reacciones orgánicas se dividen en: adición, eliminación, sustitución y condensación (adición-eliminación).
- Las rupturas de enlace pueden ser homolíticas, si el par de electrones se divide por igual entre los dos fragmentos, generando radicales libres, o heterolíticas, si el par de electrones se asocia a uno de los fragmentos, generando iones.
Sustitución nucleófila SN2
Estudios cinéticos demuestran que esta reacción ocurre en un solo paso, y la velocidad de la misma depende de la concentración tanto del haluro de alquilo como del ión hidróxido.
Otros nucleófilos que pueden usarse en esta reacción son el agua, el amoniaco, las aminas o el ión cianuro.
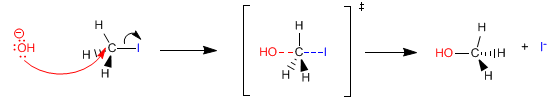
El mecanismo de la reacción puede esquematizarse del siguiente modo, usando flechas curvas:
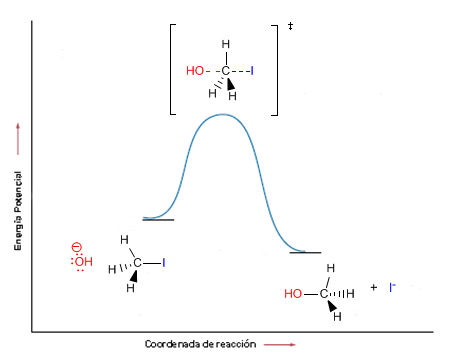
La estructura entre corchetes representa el complejo activado de la reacción, no es un intermedio aislable. El mecanismo propuesto implica una inversión de la simetría del átomo de carbono (inversión de Walden), similar a que se vuelva un paraguas por el viento, dado que el nucleófilo ataca al carbono desde del lado puesto al del haluro.
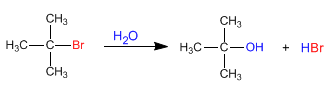
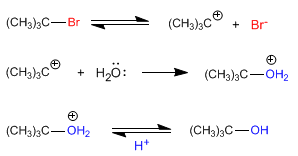
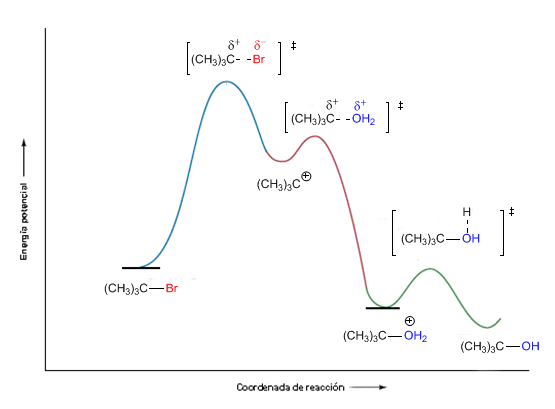
Sustitución nucleófila SN1
La reacción de sustitución de un haluro terciario, aunque sobre el papel es idéntica a la de uno primario, en realidad, el mecanismo de reacción es diferente: primero se rompe el enlace C-X, formando un carbocatión, y luego se produce la unión entre el nucleófilo y éste.
El paso determinante de la reacción es el primero: la formación del carbocatión, de modo que la reacción solo depende de la concentración de haluro de alquilo, y no de la del nucleófilo.
Factores que afectan a la sustitución nucleófila
- Naturaleza del nucleófilo: en principio, los aniones son mejores que sus correspondientes especies neutras, y dentro de éstas, son mejores aquellas que tienen átomos menos electronegativos:
- Identidad del halógeno: cuanto más débil es el enlace C-X, más fácil se rompe y mejor grupo saliente es.
- Estructura del haluro de alquilo: los carbocationes son más estables, y por tanto más fáciles de formar, cuando el carbono que porta la carga positiva está unido a otros carbonos, es decir, los carbocationes terciarios son más estables que los secundarios, y estos más estables que los primarios. Por lo tanto, los haluros terciarios reaccionan de acuerdo al mecanismo SN1, los primarios al SN2 y los secundarios exhiben ambos.
- Disolvente: los disolventes próticos (agua, etanol, ácidos carboxílicos) favorecen la reacciones SN1, mientras que los apróticos (acetona, éter, etanonitrilo), favorecen las reacciones SN2.
Adición electrófila
La AE sigue un mecanismo en dos etapas: ataque del electrófilo al doble enlace, seguido de enlace entre el carbocatión resultante y el anión sobrante.
El carbocatión que se forma es el más estable de los dos posibles, y como hemos visto en el punto anterior, este es aquél que esté más ramificado, es decir, terciarios mejor que secundarios, y estos mejor que primarios. Esta es la explicación de la regla de Marknikov.
Sustitución electrófila aromática
La SEAr es también una reacción en dos etapas:
El intermedio de reacción es un carbocatión que, como se ve, está estabilizado por resonancia.
Cada una de las variantes de esta reacción tiene un electrófilo característico:
- Nitración:
- Sulfonación: SO3
- Halogenación:
- Alquilación de Friedel-Crafts:
- Acilación de Friedel-Crafts:
Reacciones de reducción
Estas reacciones son las inversas a las oxidaciones de alcoholes que estudiamos en el punto 10.2. Los ácidos carboxílicos pueden reducirse a alcoholes primarios, pasando previamente por aldehidos, y las cetonas se pueden reducir a alcoholes secundarios. Los reactivos típicos son el LiAlH4 (hidruro de litio y aluminio) y el NaBH4 (borohidruro de sodio), aunque éste no se puede emplear para reducir ácidos carboxílicos.



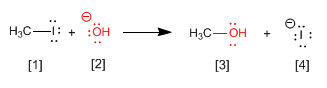





No hay comentarios:
Publicar un comentario