Tema 20: Química orgánica. 20.3 Estereoisomería
La isomería estructural se trata en el punto 10.1. Aquí sólo trataremos las isomería espacial o estereoisomería.
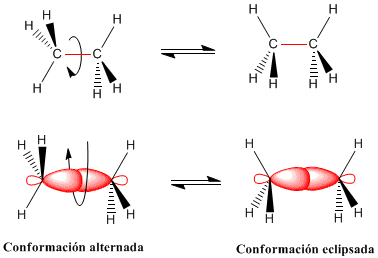
La isomería conformacional se da entre especies que se pueden convertir una en la otra mediante un giro alrededor de un enlace simple. Los confórmeros tienen entre sí pequeñas diferencias de energía, que pueden ser superadas simplemente por la energía térmica ambiental, y por tanto se están interconvirtiendo entre sí continuamente.
Un caso interesante es el de las formas silla y bote del ciclohexano, y por ende, de todas las moléculas con esa base estructural:
Los isómeros configuracionales no son interconvertibles entre sí si no ha y de por medio una ruptura de algún enlace químico. De entre ellos, los isómeros cis-trans se han estudiado en el punto 10.1 asociados a los dobles enlaces:
Sin embargo, no son exclusivos de los alquenos, siempre que haya una rotación impedida por algún medio, va a existir la posibilidad de esta isomería, por ejemplo en los cicloalcanos:
Cuanto mayor sea el tamaño del ciclo, mayor va a ser el número de isómeros de este tipo posibles.
Para los casos en que los grupos no son idénticos, la nomenclatura cambia, y se emplea la Z-E, donde Z equivale a la forma cis y E a la trans. Los grupos que determinan la nomenclatura son los que tengan un mayor número atómico a cada lado del enlace:
Finalmente, tenemos la isomería óptica. Los isómeros ópticos son compuestos químicos que tienen exactamente la misma estructura, salvo que son imágenes especulares no superponibles el uno del otro. Esto se produce cuando las moléculas presentan carbonos quirales o asimétricos, que son aquellos que están unidos a cuatro cadenas o átomos diferentes. La quiralidad es consecuencia de la simetría de los enlaces tetraédricos del átomo de carbono.
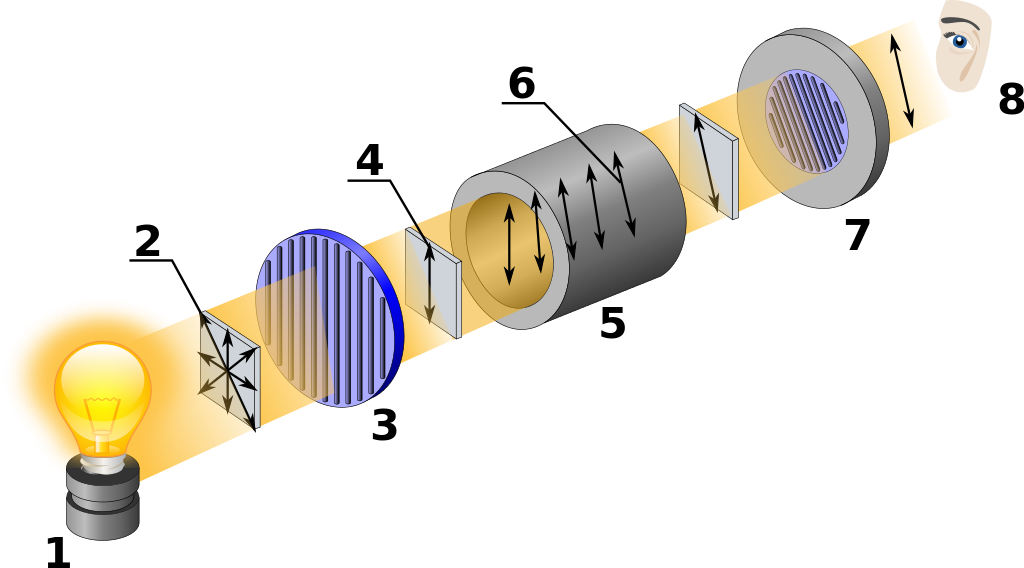
Los isómeros ópticos se diferencian físicamente porque aun cuando ambos desvían el plano de polarización de la luz polarizada, uno lo hace hacia la derecha (dextrógiro, D) y el otro hacia la izquierda (levógiro, L) en exactamente la misma cantidad. Esto se mide con un polarímetro, cuyo esquema es el siguiente:
La luz (1) no polarizada (2) pasa por un primer polaroide (3), que filtra un determinado plano de polarización (4), luego pasa por la disolución que contiene la sustancia ópticamente activa (5), que rota el plano de polarización (6), emergiendo luz polarizada, pero en un plano distinto, el ángulo se mide rotando un segundo plano de polarización (7) hasta que por el visor (8) se ve la luz a la máxima intensidad posible.
Cuando en una síntesis orgánica, el producto puede ser ópticamente activo, se generan partes iguales de ambos isómeros, y la mezcla resultante no desvía el plano de la luz polarizada. Es lo que se llama un racémico o mezcla racémica. Para sintetizar uno solo de los isómeros ópticos, es necesario que los reactivos que lo van a a generar ya sean ópticamente activos.
Los isómeros ópticos son idénticos en cuanto a propiedades químicas salvo cuando tienen que reaccionar con compuestos que también tienen isomería óptica. Ejemplo de ello son ciertos medicamentos, cuyo efecto sobre el orgnanismo es muy diferente en función de que sean uno u otro isómero óptico. Por ejemplo, la L-dopa es un medicamento contra el Parkinson, en tanto que la D-dopa es tóxica para el organismo.
Como curiosidad, los monosacáridos del ser humano son todos D, mientras que los aminoácidos son todos L.
Cuando una molécula tiene más de un carbono quiral, se producen varias parejas de enantiómeros. Un miembro de una de estas parejas, respecto de otro de otra pareja, se dice que son diastereoisómeros:
Suscribirse a:
Comentarios (Atom)




No hay comentarios:
Publicar un comentario